Um recente levantamento mostra que a maioria dos estudos clínicos com células-tronco relata segurança e efeitos positivos, mas aponta também que, em muitos casos, os resultados não são divulgados.
A grande expectativa que se criou em torno das células-tronco como ferramenta terapêutica levou a ciência, os agentes públicos e a indústria a investir vultosas quantias e esforços na pesquisa dos potenciais destas células. Porém, as mesmas características que tornam as células-tronco tão interessantes do ponto de vista clínico (sua capacidade de auto-renovação, diferenciação, migração para outros tecidos) também podem trazer consequências indesejáveis para o organismo. Por isso, os estudos clínicos são de fundamental importância para se atestar a segurança, em primeiro lugar, de um tratamento com células-tronco.
Mais do que isso, os resultados destes estudos clínicos precisam ser publicados de forma a garantir que toda a comunidade científica tenha acesso a estes dados, evitando-se a repetição de estudos, gastos desnecessários de dinheiro e, principalmente, evitando-se que outros pacientes sejam colocados em risco no caso de estratégias terapêuticas comprovadamente inseguras ou ineficazes.
Em uma revisão recentemente publicada na revista Stem Cell Reports, uma revista mantida pela Sociedade Internacional para Pesquisa em Células-Tronco (ISSCR – International Society for Stem Cell Research), pesquisadores canadenses fizeram um levantamento do número de estudos clínicos com células-tronco registrados em bancos de dados que monitoram estes estudos e avaliaram quais as suas características, quais os resultados obtidos e, principalmente, quantos deles tiveram seus resultados publicados.
Dos 1052 estudos encontrados, 103 haviam sido suspensos, 556 ainda estavam em andamento e 393 haviam sido completados. Considerando todos os estudos, o levantamento apontou que a maioria deles se trata de estudos clínicos fase I, utilizam células mesenquimais autólogas (ou seja, do próprio paciente) e estão sendo realizados em países desenvolvidos com financiamento público (veja um sumário na tabela abaixo).
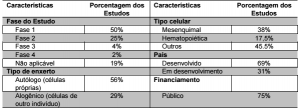
![]()
Dos 393 estudos completados, apenas cerca de metade (179) tinham seus resultados publicados em revistas científicas. Destes todos, 88% reportaram segurança do tratamento, 67% relataram efeitos positivos com relação à condição tratada e 21% relataram não ter obtido melhora clínica dos pacientes, mas também nenhum efeito adverso.
Estes resultados são encorajadores pois, a princípio, demonstram a segurança do uso de células-tronco para terapias. Porém, como também observado por este mesmo levantamento, muitos estudos não tiveram seus resultados publicados. É impossível avaliar se isto se deve ao fato de que estes estudos observaram efeitos adversos e pouca eficácia para o tratamento. No entanto, é sabido que na ciência muitos resultados negativos, que vão contra a hipótese inicial do pesquisador, não são publicados porque não têm o mesmo impacto de um resultado positivo. E isto ocorre inclusive com relação a estudos clínicos com drogas ou outras medidas de intervenção terapêutica, o que representa um problema muito sério, uma vez que estes dados estão relacionados à saúde e envolvem a utilização de seres humanos no processo. Por outro lado, os autores do trabalho também ressaltam algumas limitações de seu próprio estudo que podem ter influenciado estes números: primeiro, o status (se concluído, em andamento ou suspenso) do estudo podia não estar atualizado no banco de dados pesquisado, bem como as informações sobre a publicação dos resultados; e segundo, eles limitaram sua busca por publicações relativas a estes estudos clínicos apenas a publicações em inglês.
De qualquer forma, a revisão realizada pelo grupo aponta para a importante questão da responsabilidade dos pesquisadores em reportar os resultados, independentemente se positivos ou negativos. Importante também ressaltar que estes resultados devem ser divulgados primeiramente em revistas especializadas e que passam por processo de revisão por outros pesquisadores, antes de serem comunicados à mídia ou a grupos associados a causas de pacientes com doenças específicas. Esta é uma responsabilidade ética do pesquisador, especialmente considerando-se a grande expectativa dos pacientes com relação às células-tronco.
Nota: A ISSCR divulgou em 2016 um guia com diretrizes fundamentais para a pesquisa com células-tronco para fins terapêuticos, em que ressalta justamente a importância e a responsabilidade ética do pesquisador com relação à divulgação dos resultados de seus estudos clínicos (o qual pode ser visto aqui: http://www.isscr.org/docs/default-source/guidelines/isscr-guidelines-for-stem-cell-research-and-clinical-translation.pdf?sfvrsn=2). Em paralelo, a entidade também divulgou um guia para pacientes com as principais questões a se considerar quando há interesse em se participar como voluntários em estudos clínicos com células-tronco (o guia pode ser encontrado em português neste link: http://www.closerlookatstemcells.org/docs/default-source/patient-resources/patient-handbook—portuguese.pdf).
Referência: Fung et al., Responsible Translation of Stem Cell Research: An Assessment of Clinical
Trial Registration and Publications.Stem Cell Reports. 2017. 9;8(5):1190-1201.









