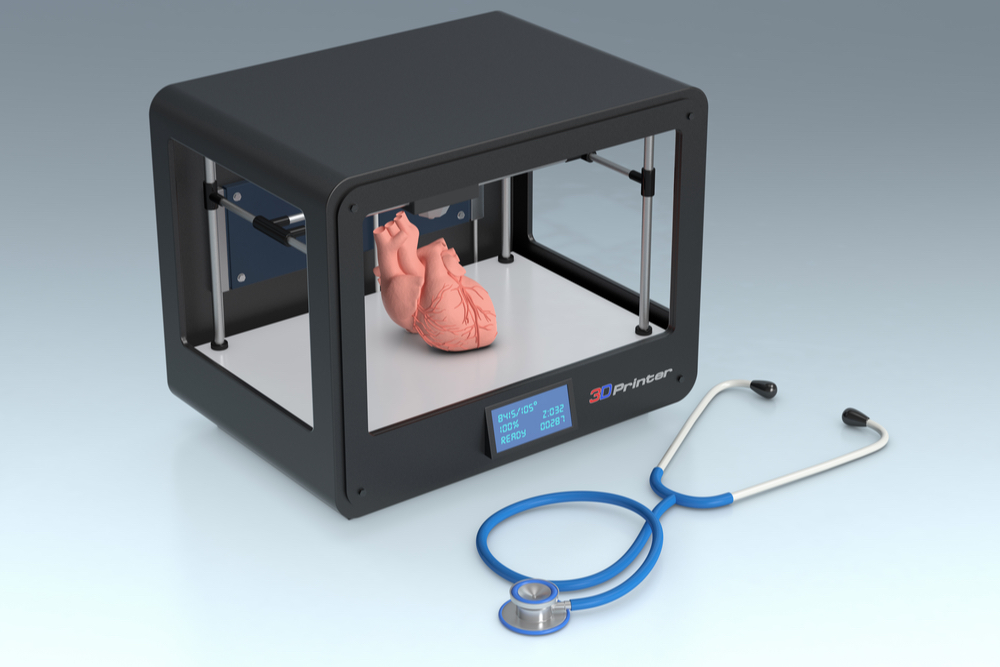
A bioimpressão 3D surgiu há alguns anos como uma técnica promissora para fornecer soluções para a área de engenharia de tecidos e órgãos. Tendo em vista os avanços científicos e tecnológicos alcançados ao longo desses anos, o quão perto estamos de obter tecidos e órgãos prontos para serem transplantados em pacientes?
A engenharia de tecidos é uma abordagem utilizada para promover a regeneração de tecidos e órgãos, na qual um biomaterial é usado como suporte para o crescimento celular na presença de fatores de crescimento. A idéia é que, quando implantado, o biomaterial seja absorvido aos poucos pelo próprio organismo, enquanto as células associadas a ele formam e regeneram um novo tecido ou órgão.
A biofabricação é um ramo da engenharia de tecidos que consiste na geração automatizada de produtos biologicamente funcionais com organização estrutural, a partir de células vivas, moléculas bioativas ou agregados celulares. Tal organização pode ser conseguida com o uso de diferentes estratégias, dentre elas, a bioimpressão 3D.
A tecnologia de impressão 3D, também conhecida como manufatura aditiva, consiste no uso de um programa computacional para a geração de um modelo virtual de um objeto tridimensional, que é transformado em um modelo físico real construído pela impressora camada a camada. Princípios da manufatura aditiva são usados, neste caso, para fornecer soluções na área de engenharia tecidual.
A bioimpressão 3D alia conceitos de biologia, engenharia e ciência dos materiais e permite a construção de um tecido ou órgão artificial por meio da organização 3D precisa e simultânea de vários tipos celulares, o que leva à geração de uma estrutura complexa com multicomponentes. As principais tecnologias de bioimpressão 3D utilizadas incluem a bioimpressão por jato de tinta (do inglês, inkjet), a bioimpressão com o uso de um feixe de laser (também conhecida como laser-assisted), as tecnologias de extrusão, e também abordagens em que esferóides celulares são utilizados como pequenos blocos para a construção do novo tecido (do inglês, scaffold-free). Tais tecnologias são interessantes pois permitem vislumbrar a possibilidade de produção de tecidos e órgãos em larga escala.
As tecnologias de bioimpressão 3D surgiram há cerca de 15 anos, quando esforços começaram a ser investidos para o desenvolvimento nessa área. No entanto, mesmo após quase duas décadas de estudos e de pesquisas, ainda existem muitos desafios para que o uso destas tecnologias seja feito em grande escala. Os dispositivos disponíveis para tais tecnologias, tanto no que diz respeito a hardwares quanto a softwares, são majoritariamente adaptados de outras tecnologias e não foram criados especificamente para esta aplicação. Isto dificulta tanto a operação prática das máquinas de impressão quanto a modelagem computacional dos órgãos e tecidos a serem impressos.
Outro problema que precisa ser resolvido está nos materiais a serem utilizados na bioimpressão. No caso da tecnologia por jato de tinta, por exemplo, são utilizadas as chamadas biotintas (ou bioinks). Estes materiais devem manter um compromisso entre fornecer um ambiente propício para que as células se mantenham viáveis e, ao mesmo tempo, garantir a estabilidade estrutural e conformacional do órgão ou tecido em potencial. As biotintas normalmente são constituídas de hidrogéis e sua viscosidade afeta diretamente sua capacidade de impressão: os hidrogéis com pouca viscosidade fluem após depositados pelo bico de impressão e a estrutura impressa pode desmoronar; enquanto hidrogéis de viscosidade maior não são adequados para a migração, proliferação e diferenciação celular. É necessário encontrar um meio-termo, e isso tem sido o foco de diversos estudos na área de bioimpressão.
Além dos desafios já mencionados, uma outra questão importante a ser tratada está relacionada à vascularização destes tecidos e órgãos impressos. Sem um sistema circulatório funcional, os tecidos obtidos têm a difusão de nutrientes e metabólitos limitada a apenas algumas centenas de microns de espessura. A construção de redes vasculares complexas que possibilitem a perfusão de todo o tecido ou órgão é ainda difícil de ser atingida pela tecnologia de bioimpressão 3D.
Mesmo se formada uma estrutura biológica complexa e vascularizada, seu pós-processamento é necessário para se conseguir um tecido ou órgão funcional. Isso inclui a maturação e/ou diferenciação celular, e o ideal é que o pós-processamento seja feito de modo a promover uma difusão efetiva de nutrientes através da estrutura, evitando a manipulação e diminuindo o risco de contaminação do material biológico. Isso poderia ser feito com o uso de um equipamento chamado “biorreator”, mas biorreatores adequados a esta finalidade não são comumente disponíveis comercialmente. O ideal é que, no futuro, as etapas de bioimpressão e maturação sejam feitas de forma integrada, em uma única plataforma, a fim de otimizar o processo de obtenção de tecidos e órgãos viáveis e funcionais.
Há ainda as barreiras ética e legal para a consolidação das tecnologias de bioimpressão 3D: o caminho para aceitação por agências reguladoras e mesmo pela sociedade é árduo e longo. Como toda tecnologia emergente, a bioimpressão 3D de tecidos e órgãos pode gerar questionamentos quanto aos aspectos éticos e também levar longo tempo para que seja aprovada legalmente. No entanto, muitos esforços vêm sendo empenhados no aprimoramento desta tecnologia e é possível que, mais cedo do que imaginamos, produtos advindos de sua utilização estarão no mercado.
Deve-se pensar, neste sentido, sobre a facilidade de acesso a estas tecnologias. Espera-se que, quando realizadas, elas sejam acessíveis a qualquer pessoa, no entanto, ao menos a princípio, isso não é verdade. São tecnologias caras e a maioria das pessoas não poderá pagar por elas. Além disso, para seu uso, são necessários infraestrutura e pessoal capacitado, o que limita ainda mais a perspectiva de futuros usuários.
Apesar de todas as dificuldades, a força motriz para as pesquisas e investimentos em tecnologias de bioimpressão 3D é poderosa. A demanda de órgãos para transplantes é infinita: a cada dia, as filas de pessoas à espera de um órgão aumentam. A escassez de órgãos para doação motiva os investimentos em soluções alternativas. E a bioimpressão 3D pode atuar não só suprindo soluções nesta vertente, como também fornecendo tecidos e órgãos artificiais para fins não terapêuticos como, por exemplo, modelos de doenças para teste de drogas personalizadas.
Mas afinal, o quão próximos estamos de imprimir tecidos e órgãos? Alguns grupos de pesquisadores preveem a obtenção de tecidos e órgãos relativamente mais simples, como pele e cartilagem, nos próximos 5 a 10 anos. Já no caso de órgãos mais complexos, como coração, fígado e rins, ainda não há previsão de sua obtenção. No entanto, o coração pode ser considerado como um bom começo para tais pesquisas em bioimpressão, uma vez que, apesar de sua estrutura complexa, não desempenha funções bioquímicas complexas como o fígado e os rins, e é bem compreendido pela ciência (ao contrário do cérebro, por exemplo).
No próximo texto com a temática de bioimpressão 3D, vamos abordar exemplos de aplicações de células-tronco aliadas a esta tecnologia, e os principais avanços já alcançados pela comunidade científica.
Referências:
Dernowsek et al. (2017) The role of information technology in the future of 3D biofabrication. Journal of 3D Printing in Medicine, 1, 63–74
Groll, J. et al.(2016) Biofabrication: reappraising the definition of an evolving field. Biofabrication, 8, 013001.
Malda et al.(2013) Engineering hydrogels for biofabrication. Advanced Materials, 25, 5011–5028.
Moroni et al.(2018) Biofabrication: A guide to technology and terminology. Trends in Biotechnology, 36, 384–402.
Satyajit Patra; Vanesa Young (2016). A Review of 3D printing techniques and the future in biofabrication of bioprinted tissue. Cell Biochemistry and Biophysics, 74, 93–98.
https://www.biofabricacao.com/single-post/2018/10/22/Desafios-da-Bioimpress%C3%A3o