A Esclerose Lateral Amiotrófica é uma doença neurodegenerativa ainda sem cura conhecida, que leva à paralisia muscular irreversível. Uma plataforma desenvolvida por pesquisadores americanos com base na tecnologia de “órgãos em chips” mostrou ser um modelo válido da doença, reproduzindo as deficiências musculares apresentadas pelos pacientes em um microchip. O sistema pode ser utilizado de forma personalizada para o desenvolvimento de terapias para pacientes com diversos subtipos da doença.
A Esclerose Lateral Amiotrófica (ELA) é uma doença que afeta o sistema nervoso de forma degenerativa e progressiva, levando à paralisia motora irreversível. Os neurônios afetados tornam-se incapazes de transmitir os impulsos nervosos aos músculos (veja na Figura 1). Pacientes com a doença sofrem paralisia gradual e morte precoce como resultado da perda de capacidades cruciais, como falar, movimentar, engolir e até mesmo respirar. O físico britânico Stephen Hawking, morto em 2018, foi uma das pessoas com ELA mundialmente mais conhecidas (leia mais sobre a doença no portal do Ministério da Saúde).
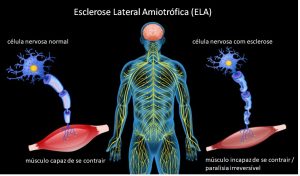
Figura 1: Esclerose lateral amiotrófica (clique para ver a figura original).
Ainda não há uma cura conhecida para a ELA e a comunidade científica vem explorando diferentes estratégias para entender e para combater a doença. No entanto, um grande obstáculo inerente ao desenvolvimento de um tratamento eficaz para a ELA é a heterogeneidade desta doença. As causas da ELA variam muito, podendo ser de origem genética, envolver mecanismos celulares e moleculares variados, bem como participação de diferentes tipos de células e manifestação clínica. Essa variabilidade das características da doença torna difícil desenvolver um modelo ou encontrar uma terapia que possa ser aplicável a todos os casos. No entanto, uma condição comum é compartilhada por todos os pacientes: a perda progressiva das junções neuromusculares (NMJs, do inglês neuromuscular junctions) e morte dos neurônios motores. Assim, quaisquer terapias que possam proteger ou restaurar a integridade das NMJs são potencialmente benéficas para os pacientes com qualquer subtipo da ELA.
Uma tecnologia desenvolvida por pesquisadores da University of Central Florida, nos EUA, pode servir como um modelo clínico personalizado e mais confiável da ELA, além de ser uma melhor ferramenta de triagem para novas terapias do que os modelos pré-clínicos atualmente usados. O estudo foi publicado recentemente na revista Advanced Therapeutics. Trata-se de uma plataforma que incorpora a tecnologia “Human-on-a-Chip” ou “humano em um chip” e que foi desenvolvida pelo professor James J. Hickman e licenciada para a Hesperos, Inc., uma empresa de biotecnologia fundada por Hickman e pelo Dr. Michael L. Shuler, da Cornell University.
Já falamos aqui no blog sobre a tecnologia de órgãos em chips e “humano em um chip” (relembre aqui). Esta tecnologia se baseia no uso da microfluídica, uma ferramenta poderosa que envolve a utilização de dispositivos minúsculos e, com o cultivo de células vivas em microcanais, permite replicar as funções de tecidos e órgãos humanos em um microchip.
Os pesquisadores americanos descrevem no novo estudo publicado um modelo da doença que compreende neurônios motores derivados de células-tronco pluripotentes induzidas (iPSCs) de pacientes com ELA e células musculares humanas primárias colocadas em um sistema compartimentalizado com várias câmaras minúsculas. O sistema desenvolvido foi capaz de reproduzir testes comumente empregados em clínicas para avaliar os sintomas da ELA, nos quais um paciente recebe uma tarefa e deve realizá-la com velocidade cada vez maior, o que permite avaliar os reflexos musculares e detectar perda de força muscular. Esse teste foi reproduzido estimulando os neurônios motores com uma frequência crescente por meio de estímulos elétricos e monitorando o músculo para registrar espasmos ou como fadiga acelerada.
As iPSCs utilizadas foram derivadas de pacientes com três subtipos diferentes de ELA, sendo que duas das linhagens celulares expressavam mutações no gene “SOD1” e uma expressava uma mutação no gene “FUS”. Em comparação com controles saudáveis, cada uma das três linhagens celulares de neurônios motores com ELA exibiu fenótipos patológicos específicos para mutações com diferentes graus de gravidade.
Quando os neurônios motores derivados de pacientes com ELA foram incubados no sistema de câmara dupla com tecido muscular, NMJs funcionais foram formadas, sem morte celular de axônios (prolongamentos dos neurônios) transportados através de minúsculos túneis para a câmara com células musculares. No entanto, houve deficiências significativas na formação das NMJs, na transmissão da atividade elétrica e na contração muscular com o aumento da frequência de estimulação dos neurônios. Esses dados sugerem que o sistema é um modelo válido, que reproduz os déficits morfológicos e funcionais da ELA.
O sistema também foi utilizado para testar o “Protocolo de Deanna”. Trata-se de um regime de suplementos que contém cinco componentes direcionados a vários mecanismos celulares conhecidos por serem patologicamente alterados na ELA e que está disponível comercialmente. Embora essa estratégia esteja ganhando força entre os pacientes de ELA, não havia anteriormente nenhuma evidência científica em um modelo funcional humano que apoiasse seu uso terapêutico. No estudo, após o tratamento com o protocolo de Deanna, os déficits funcionais das junções neuromusculares foram revertidos. Especificamente, o tratamento levou a melhorias significativas na formação das NMJs, na transmissão da atividade elétrica e nas contrações musculares, mesmo em frequências mais altas de estimulação.
A equipe está entusiasmada com os resultados e afirma que a plataforma desenvolvida pode ser empregada de forma personalizada é aplicável a todos os casos de ELA, tanto para fins de estudos da origem da doença, como para testes de medicamentos e desenvolvimento novas terapias.
Referências
Researchers utilize Human-on-a-Chip approach to model ALS pathology (12/08/2020): https://neurosciencenews.com/als-human-chip-16816/